Молекулярные колебания
Молекулярные колебания один из трёх типов молекулярного движения, к которым относятся также
трансляционное движение (когда все атомы молекулы смещаются в одном направлении) и
вращательное движение (когда молекула поворачивается на определённый угол). В отличие от
последних двух случаев, когда геометрия молекулы не меняется, при колебаниях происходит
изменение положения атомов относительно друг друга.
В общем случае, молекула из N атомов обладает 3N — 6 нормальными колебаниями, за
исключением линейных молекул, у которых 3N — 5 колебаний. Двухатомная молекула,
как частный случай линейной, обладает всего одним колебанием, при котором меняется
расстояние между двумя атомами молекулы.
Типы колебаний
В случае многоатомных молекул колебания довольно сложны и их обычно описывают как комбинацию
колебаний разных фрагментов молекулы. Часто это трёхатомные фрагменты молекулы, например
метиленовая группа (-CH2-) в органических молекулах. Можно выделить шесть типов колебаний
трёхатомного фрагмента молекулы: симметричное и антисимметричное валентные колебания,
ножничное, маятниковое, веерное и крутильное. Следует отметить, что для молекул содержащих
только три атома, например молекулы воды, последние три типа колебаний не существуют, так как в
данном случае они соответствуют просто вращениям молекулы относительно трёх
взаимно перпендикулярных осей (для этих колебаний расстояния между тремя атомами фрагмента не
меняются).
| Валентные колебания (Stretching) | Ножничное (Scissoring) | |
|---|---|---|
| Симметричное | Антисимметричное | |
 |  |  |
| Маятниковое (Rocking) | Веерное (Wagging) | Крутильное (Twisting) |
|---|---|---|
 |  |  |
Классическая механика
ведут себя как пружины. В гармоническом приближении колебания подчиняются закону Гука: Сила  ,
,
В классической механике колебания молекулы рассматриваются с позиции, что связи между атомами
которую требуется приложить для растяжения пружины, прямо пропорциональна величине
растяжения  . Константа пропорциональности в случае молекулярных колебаний называется
. Константа пропорциональности в случае молекулярных колебаний называется
силовой константой, 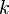 .
.
Из Второго закона Ньютона эта сила равняется также произведению приведённой массы  и ускорения:
и ускорения:
Из этого получаем обыкновенное дифференциальное уравнение:
Решением которого являются гармонические колебания:
где  — амплитуда координаты колебания
— амплитуда координаты колебания  . Для двухатомной молекулы AB приведённая
. Для двухатомной молекулы AB приведённая
масса  равняется:
равняется:
 , где mA и mB — массы атомов A и B.
, где mA и mB — массы атомов A и B.
В гармоническом приближении потенциальная энергия молекулы 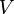 является квадратичной
является квадратичной
функцией от нормальной координаты. В этом случае силовая константа равна второй производной
потенциальной энергии:
Квантовая механика
В квантовой механике, также как и в классической, потенциальная энергия гармонического
осциллятора является квадратичной функцией от нормальной координаты. Из решения уравнения
Шрёдингера возможны следующие значения энергии колебаний:
 ,
,
где n — квантовое число, которое принимает значения 0, 1, 2 ... В молекулярной спектроскопии это
колебательное квантовое число часто обозначается как v, так как возможны и другие типы энергии
молекулы, которым соответствуют другие квантовые числа.

Молекула HCl как пример ангармонического осциллятора колеблющегося с энергией E3. D0 — энергия диссоциации
, r0 —длина связи, U — потенциальная энергия. Энергия выражена вволновых числах.
Информация взята с сайта ru.wikipedia.org




